المقدمة
تقدمت أبحاث الخلايا الجذعية بشكل كبير على مدى العقود القليلة الماضية، مما أدى إلى إمكانيات رائدة في الطب التجديدي. حيث تمثل مصادر الخلايا الجذعية التقليدية، مثل الخلايا الجذعية الجنينية، تحديات وقيودًا أخلاقية. لقد تغلب ظهور iPSCs، المشتقة من الخلايا الجسدية البالغة، على العديد من هذه العقبات. ستستكشف هذه الورقة إمكانية تمييز iPSCs إلى أنسجة مختلفة، مما يوفر إمكانية إصلاح أو استبدال الأنسجة والأعضاء التالفة.
معلومات أساسية:
تم تطوير الخلايا الجذعية المستحثة متعددة القدرات (iPSCs) لأول مرة في عام 2006 من قبل شينيا ياماناكا، التي أثبتت أنه يمكن إعادة برمجة الخلايا الجسدية البالغة إلى حالة متعددة القدرات. حيث تشترك iPSCs في خصائص مماثلة للخلايا الجذعية الجنينية، بما في ذلك القدرة على التمييز في جميع الطبقات الجرثومية الثلاث، مما يجعلها متعددة الاستخدامات لمختلف تطبيقات هندسة الأنسجة.ويتجاوز استخدامها المخاوف الأخلاقية المرتبطة بالخلايا الجذعية الجنينية. على الرغم من إمكاناتها، لا تزال هناك تحديات مثل الأورام ورفض المناعة والحاجة إلى بروتوكولات تمايز فعالة.
الأساليب:
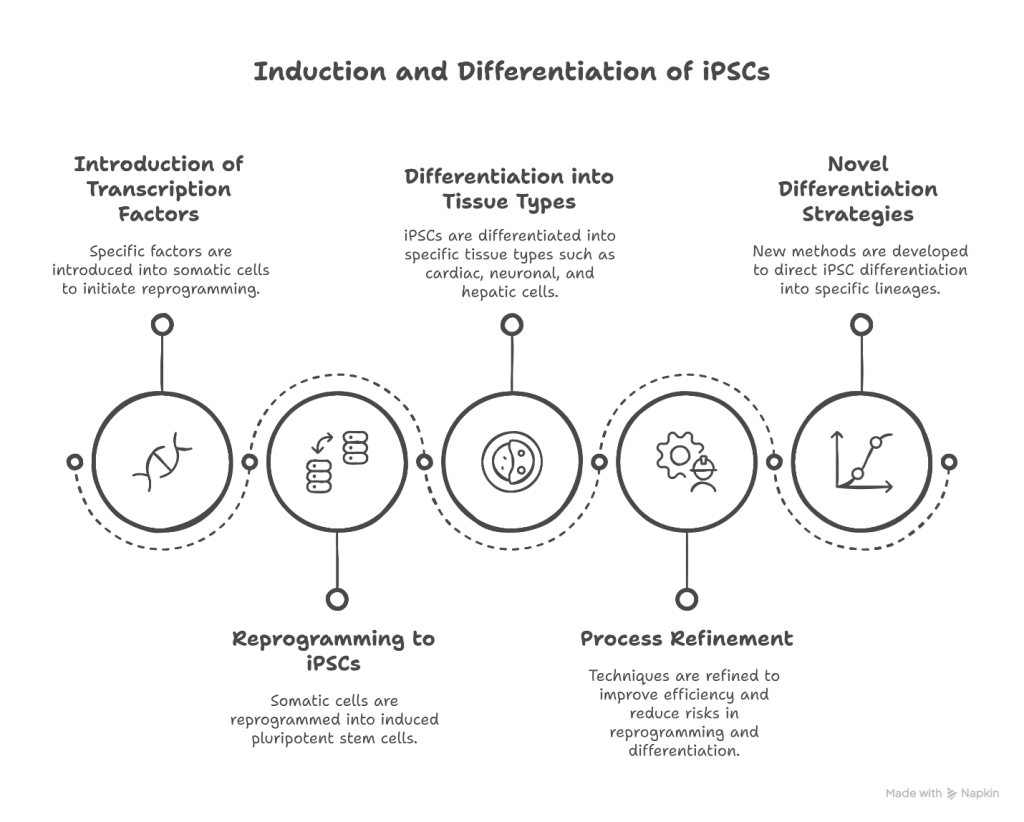
دور الخلايا الجذعية في الهندسة الحيوية للأنسجة :
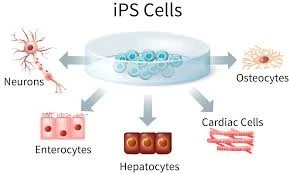
تلعبالخلايا الجذعية دورًا محوريًا في مجال الهندسة الحيوية للأنسجة من خلال العمل كمصدر للخلايا الخاصة بالمريض القادرة على التمييز إلى أنواع الأنسجة المختلفة. يمكن دمج هذه الخلايا مع السقالات الحيوية – مثل الهلاميات المائية الطبيعية أو البوليمرات الاصطناعية أو المصفوفات خارج الخلية – لتطوير تركيبات الأنسجة الوظيفية. مكنت التطورات الأخيرة من تمايز الخلايا الجذعية إلى خلايا متخصصة مثل خلايا عضلة القلب والخلايا العصبية والخلايا الكبدية، والتي يتم زرعها بعد ذلك على سقالات ثلاثية الأبعاد لتقليد البنية الخاصة بالأنسجة والبيئة الدقيقة للأنسجة الأصلية. بالإضافة إلى ذلك، أدى تكامل الخلايا الجذعية مع تقنيات الطباعة الحيوية ثلاثية الأبعاد إلى تسهيل إنشاء تركيبات الأنسجة المعقدة، مما عزز قابلية تكرار الأنسجة المهندسة وتوسعها للاستخدام العلاجي.
التطبيقات والتطلعات المستقبلية
مع استمرار تطور التكنولوجيا المحيطة بـالخلايا الجذعية وهندسة الأنسجة، من المتوقع أن تتوسع التطبيقات المستقبلية في تصنيع أعضاء كاملة، بما في ذلك الكلى المهندسة بيولوجيًا والرئتين والقلب. فأن أحد الاتجاهات الواعدة هو تطوير ترقيع الأنسجة الشخصية للزرع، مما يقلل من خطر رفض المناعة باستخدام الخلايا الجذعية الذاتية. بالإضافة إلى ذلك، ستلعب الأعضاء على الرقاقة ونماذج الأمراض المشتقة من الخلايا الجذعية الخاصة بالمريض دورًا مهمًا في اختبار الأدوية والطب الدقيق. فقد يؤدي التقدم في تعديل الجينات، مثل CRISPR-Cas9، إلى تعزيز الإمكانات العلاجية للخلايا الجذعية عن طريق تصحيح العيوب الجينية قبل بناء الأنسجة. على الرغم من التحديات الحالية – مثل الأورام والنضج الوظيفي – تمهد الأبحاث المستمرة الطريق بشكل مطرد نحو الأنسجة والأعضاء القابلة للحياة سريريًا والمزروعة في المختبر.

